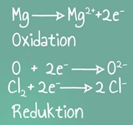NRW-Kernlehrplan
Große Materialiensammlung vom AK Kappenberg
geordnet nach Klassenstufen
am Beispiel des Kernlehrplans NRW
Ziel- Klassen bzw. Jahrgangsstufen mit direktem Link:
Kleine Zeichenerklärung - schon vorab merken!!
Generelles für alle Klassen und Jahrgangsstufen

1. Allgemeines - Labor - Chemisches Experimentieren - Sicherheit
1.1 Laborarbeiten
Labor und Sicherheit im Labor
Sicherheit im Labor
Arbeiten in Labor und Praktikum
Brände und Brandbekämpfung / Verhalten im Brandfall
Brände und Bekämpfung
1.2 Geräte
1.3 Messen
Messen-Auswerten-Simulieren
E  Analytik 18
Analytik 18
Messen-Auswerten-Simulieren
E  THAnalytik
THAnalytik

AK Mininanalytik App
Mit der App können Experimente direkt im Internet ausgewertet werden.
Gegeben ist eine Titrationskurve.
Diese soll ausgewertet werden, d.h. es sind Äquivalenzpunkt, Halbäquivalenzpunkt und ein sinnvoller Indikator zu bestimmen.
Unter Aufgaben findet man eine spezielle Anleitung für dieses Problem!
Gegeben ist eine Titrationskurve.
Diese soll ausgewertet werden, d.h. es sind Äquivalenzpunkt, Halbäquivalenzpunkt und ein sinnvoller Indikator zu bestimmen.
Unter Aufgaben findet man eine spezielle Anleitung für dieses Problem!

2. AK Gaschromatografie - ein Hauch von Wissenschaft im Unterricht
2.1 Gaschromatografie -Grundlagen-Bedienung-Wartung
Ad-/Desorption - Prinzip
Verteilung - Prinzip
Multiplikative Verteilung
A  Verteil-Chr.
Verteil-Chr.
Gaschromatografie
Vom Auge zum WLD
Probe injizieren / Gasbar
Säulenwechsel
Septenwechsel
Birnchenwechsel
2.2 Gaschromatografie - Tolle Anwendungen

Katalytische Hydrierung Film vom Experiment
Durch Überleiten eines Gemisches aus Ethin und Wasserstoff über einen Katalysator beobachtet man eine eindrucksvolle Volumenabnahme.
Der Katalysator wird dabei warm.
Es entstehen zunächst Ethen und Ethan. Nach einer erneuten Zugabe von Wasserstoff und Hydrierung findet man nur noch Ethan!
Der Katalysator wird dabei warm.
Es entstehen zunächst Ethen und Ethan. Nach einer erneuten Zugabe von Wasserstoff und Hydrierung findet man nur noch Ethan!

Biowasserstoff Herstellung Film vom Experiment
Aus Zuckerrübenschnitzeln und Gartenerde und 80 °C heißem Wasser entsteht im "Bioreaktor" (Marmeladenglas) ein Gasgemisch.
Dieses enthält so viel Biowasserstoff, dass ohne Gaswäsche eine Brennstoffzelle betrieben werden kann, die z.B. einen Flügelmotor mit Strom versorgt!!
Dieses enthält so viel Biowasserstoff, dass ohne Gaswäsche eine Brennstoffzelle betrieben werden kann, die z.B. einen Flügelmotor mit Strom versorgt!!
GC Biowasserstoff
Alkohol n. Pralinengenuss
Alkoholreduzierte Biere
Gaschromatografie
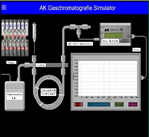
Simulator Gaschromatografie App
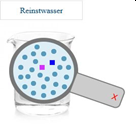
Man kann toll gaschromatografische Trennungen simulieren. Beim Druck auf „GC-Start“ sieht man, wie sich der eingespritzte Stoff durch die Trennsäule bewegt und dabei in verschiedene "Fraktionen" aufgetrennt wird. Die Signale erscheinen in Form von Peaks im Koordinatensystem des Tablets. Zur Verfügung stehen zwei Säulen und 20 Gemische bzw. Reinstoffe.

3. Chemisches Rechnen / Nachschlagen / Datenbanken
'Taschenrechner mit PSE'
Multi-Rechner
R  ChemRech
ChemRech
Rechner
Mischungs-Rechner
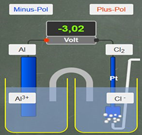
POT-Rechner
App
Gezeigt wird eine galvanische Zelle, bei der in beiden Halbzellen (mit den AK Rollen) die vorgegebenen Redoxpaare geändert werden können. Auch die Konzentrationen der Ionen in Lösungen lassen sich per Tastatur eingeben. Die Einzelpotenziale werden berechnet und die daraus resultierende Potenzialdifferenz auf dem Messgerät angegeben.
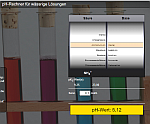
pH- Rechner
App
Es können die in der Schule üblichen Säuren und Basen, sowie Gemische (=Pufferlösungen) aus diesen ausgewählt werden. Nach Angabe der Konzentration(en) wird der zugehörige pH-Wert berechnet und die Farbe des Universalindikators angezeigt. Soll nur der pH-Wert einer reinen Lösung berechnet werden, stellt man die zweite Rolle auf "Keine".
Gasgesetze
Sim./Rech.
MOL-light mnM
MOL-light VnVm
MOL-light ncV
Chemikalien - Datenbank
Chemikalien Datenbank
App
Enthalten sind alle Chemikalien, die im Chemieunterricht eine Rolle spielen. Nach Eingabe des Namens der Chemikalie erhält man wichtige Daten dieser Verbindung. Ein Sprung zu GESTIS oder WIKIPEDIA ist für zusätzliche Informationen möglich. Falls es sich um ein Molekül der Verbindung handelt, stellt js-MOL es dreidimensional dar.

4. Arbeits- und Infoblätter
Das nun Folgende hat bis auf das 'Herunterladen' nichts mit Digitalisierung zu tun. Es handelt sich hierbei noch um übliche Arbeitsaufgaben auf Papier, die ausgedruckt und an die Schüler verteilt werden können
4.1 Die wichtigsten Arbeitsblätter:
Elemente - Zahlsilben - Gleichungen
Lösungen
Chemische Begriffe, Definitionen
Lösungen
Atombau - Periodensystem
Lösungen
Ein verkürztes Periodensystem
Lösungen
Die chemische Bindung
Lösungen
Namen anorganischer Stoffe
Lösungen
Formeln und Stoffmengen, Mo
Lösungen
Reaktionsgleichungen (mit Rückseite)
Lösungen
Stöchiom. Aufgaben (mit Rückseite)
Lösungen
4.2 Die wichtigsten Infoblätter
Das Wichtigste zum Laminieren


Periodensystem Laminiervorlage

 V04 - Ein verkürztes Periodensystem
V04 - Ein verkürztes Periodensystem
das zweitwichtigste:


 V05 - Chem. Bindungen - ultimative Übersicht
V05 - Chem. Bindungen - ultimative Übersicht
... und noch eins aus der Organik:


 V20 - Organ. Chemie: Funktionelle Gruppen
V20 - Organ. Chemie: Funktionelle Gruppen

Periodensystem Laminiervorlage
Hier gibt es ein verkürztes Periodensystem (Hauptgruppen- und einige Nebengruppenelemente) mit Metallcharakter, Valenzelektronen, Elektronegativitäten und bevorzugten Ladungszahlen etc. zum Ausdrucken als schnelles Infoblatt für die Schüler. Noch besser: man lässt es laminieren.
das zweitwichtigste:
... und noch eins aus der Organik:

5. Teacher's Helper - Unterricht mit Tablets und iPads
5.1 Teacher's Helper - Übungen, Tests und Spaß für iPad-(zur Not auch Handy-) Klassen
Auspacken und Loslegen

Elektronische Unterrichts- unterstützung
mit WLAN
Über sein eigenes WLAN kann der Teacher's Helper Lehrer- und Schüler-geräte systemunabhängig miteinander verbinden. Übungen und Tests wie das komplette AK MiniLabor lassen sich an die Schüler verteilen. Easy to use:
- WLAN AKNET einstellen
- mit Browser labor.ak anwählen
- Namen eingeben und loslegen!
- WLAN AKNET einstellen
- mit Browser labor.ak anwählen
- Namen eingeben und loslegen!

Elektronische Unterrichts- unterstützung
mit WLAN
Über sein eigenes WLAN kann der Teacher's Helper Lehrer- und Schüler-geräte systemunabhängig miteinander verbinden. Damit werden spezielle Quizrätsel der Schüler gegeneinander - ähnlich Kahoot - möglich. Diese elektrisieren so stark, dass die Schüler fast nicht merken, dass sie etwas dazulernen.
5.2 Teacher's Helper - Nützliche Editoren für die Aufgaben
5.3 Mit dem Teacher's Helper: Messwerte für Alle - Beispiel: pH-Titration
1. Kalibrieren (neuartig!)

Elektronische Unterrichts- unterstützung
mit WLAN
Der Teacher's Helper überträgt die Software AK MiniAnalytik ebenso wie die Daten auf alle Schülergeräte. Diese müssen die ankommenden Daten auch für die eigene Kalibrierung nutzen:
Neuerung bei pH: Hier werden einfach die Daten für Salzsäure (c= 0,1 mol/L) und Natronlauge c= 0,1 mol/L) für die Kalibrierung der pH-Werte 1 und 13 benutzt.
Neuerung bei pH: Hier werden einfach die Daten für Salzsäure (c= 0,1 mol/L) und Natronlauge c= 0,1 mol/L) für die Kalibrierung der pH-Werte 1 und 13 benutzt.

Elektronische Unterrichts- unterstützung
mit WLAN
Durch Kopplung mit Messgeräten, wie dem All-Chem-Misst II oder dem Gaschromatographen wird es möglich, dass jeder Schüler die Entwicklung einer Titrationskurve oder eines Gaschromatogramms auf seinem eigenen Endgerät (Tablet oder sogar Handy) verfolgen kann.
3. Auswertungen

Elektronische Unterrichts- unterstützung
mit WLAN
Die vom Teacher's Helper auf das eigene Endgerät (Tablet oder sogar Handy) eines Schülers aufgespielte Software 'AK MiniAnalytik' bleibt bis zum Löschen des Cache ebenso wie die aufgenommenen Daten erhalten. Dadurch werden auch Auswertungen der Experimente zuhause möglich.
Klasse 7 - - Chemistry Kids

7.1 Stoffe im Alltag – Stoffeigenschaften
7.1.1 Stoffeigenschaften (messbar / nicht-messbar)
Eigenschaften der Stoffe
Temperaturverlauf: Erhitzen von Wasser
Taschenwärmer (Kristallisationswärme)
Druckverflüssigung
Aggregatzustände
FWU
Dichte von Gasen
planetschule.de
Wasserstoff -pneumatisch
ChemDidaktik-BUW
Aufsteigende Flamme in Schlauch-Spirale
'Schiff' schwimmt auf Kohlenstoffdioxid
Elektr. Leitfähigkeit: Alltagsstoffe
Elektr. Leitfähigkeit: Flüssigkeiten
7.1.2 Gemische und Reinstoffe / Stofftrennverfahren
Reinstoffe / Gemische
Reinstoffe und Gemische
musstewissen Chemie
Eigenschaften der Stoffe
Elemente nach AB04
Wichtige Elemente
Elemente Top 50
Sauerstoffanteil der Luft

Sauerstoffgehalt der Luft
Film vom Experiment
Es wird ein Versuch gezeigt, mit dem man den Sauerstoffanteil der Luft quantitativ bestimmen kann. Dazu wird der Sauerstoff der Luft durch die Reaktion mit Kupfer zu festem Kupferoxid gebunden. Die restlichen gasförmigen Bestandteile der Luft (fast nur Stickstoff) bleiben übrig.
Stofftrennungen
Trennungen
Trennungen
Destillation von Rotwein
Tafelkreidenchromatografie
7.1.3 Einfaches Modell / Teilchenmodell
Aggregatzustände
Teilchenmodell/ Aggregatzustände
Teilchenmodell/Aggregatzustände

7.2 Chemische Reaktionen in unserer Umwelt
7.2.1 Stoffumwandlung bei chemischen Reaktionen
Kalkkreislauf 1. Kalk Brennen
Kalkkreisl. 2. Branntkalk Löschen
Kalkkreisl. 3. Abbinden Löschkalk
Wir bauen mit Kalkmörtel
E ????
Der Kalkkreislauf
Siegfried Schmuck
7.2.2 Energieumwandlung bei chemischen Reaktionen (Aktivierungsenergie, exotherm, endotherm) auch: 11.2.5
Zink-Iod-Akku

Zink-Iod-Akku
Film vom Experiment
Das Laden und Entladen eines Zink-Iod-Akkus wird gezeigt. Das Laden der Zelle erfolgt durch ein Gebläse, das einen einem Generaor antreibt. Die Bildung von Iod ist deutlich zu sehen. Das Entladen der Zelle erfolgt durch einen Motor, der sich in die gleiche Richtung weiterdreht (zum Nachdenken!).
Entzündungstemp.Streichholz
Kalkkreislauf 1. Brennen von Kalk
Kalkkreislauf 2. Löschen von Branntkalk
Kalkkreislauf 3. Abbinden von Löschkalk
Total Phänomenal-Multitalent Erdöl
otmarvdh
Benzinexplosion im Filmdöschen
Brennwert von Lebensmitteln
endotherm-exotherm (einfach)
TM Chemie
endotherm-exotherm
studyflix

7.3 Facetten der Verbrennungsreaktion
7.3.1 Verbrennung als Reaktion mit Sauerstoff
7.3.2 Oxidbildung, Zündtemperatur, Zerteilungsgrad
Wasserstoff im Ballon
ChemDidaktik-BUW
Entflammen von Wachs
Versuche mit Wachsdampf
Brennen Feststoffe nicht? Nur als Gas?
Die Rolle des Kerzen-Dochtes
Entflammen verschiedener Flüssigkeiten
Chemik.: brennbar+ brandfördernd:
Gummibärchens Flammentod
Wunderkerzen unter Wasser
Zerteilungsgrad:
Der Petroleumzerstäuber
Feuerspucken
Zündung im Automotormodell
Wachs explodiert in kaltem Wasser?
Löschen:
Feuer löschen / CO2 Umgießen
Benzinbrände - Löschen mit Wasser?
Brandfrage für Feuerexperten
Anwendungen:
'Steyrischer Hochzeitsböller' - Knallt!
Feuersäule - Tornado
Benzinexplosion im Filmdöschen
Cola-Rakete mit Feuerzeuggas
Die 'Erdgasmamba'
Entflammt eine Kerze einen Papiertrichter ohne und mit Wasser?
Feuer in der Schlauch-Spirale
Geheimnisvoll pulsierendes Herz

7.4 Chemische Elemente und Verbindungen
7.4.1 Analyse, Synthese
Zerlegung von Silberoxid
Synthese von Kupfersulfid
Elemente
Elemente (erw.)
Elemente-Datenbank im PSE
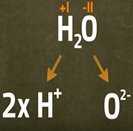
7.4.2 Wasser - beispielhafte Verbindung
Flüss. Wasser - Glimmspan: Sauerstoffnachweis
E 
 0:44
0:44
'Wasser-Wasser'- Qualitative Analyse
'Wasser-Wasser'-Qual. An. im Reagenzglas
Qualitative Synthese aus Wasserstoff
Synthese Wasserstoff mit Sauerstoff
Halbquantitative Wassersynthese
Synthese von Wasserdampf
E Film ??
7.4.3 Nachweisreaktionen
Einfache Gasherstellung
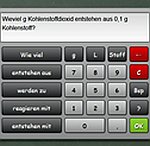
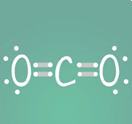
Spezial: Trockeneis
E ????
Wasserstoff - Knallgasprobe
Sauerstoff - Glimmspanprobe
Kohlendioxid - Baryt-Wasser
Kohlendioxid in der Atemluft
Wasser - WATESMO-Papier
7.4.4 Umkehrbarkeit chemischer Reaktionen
Zink-Iod-Akku

Zink-Iod-Akku
Film vom Experiment
Im Video wird das Laden und Entladen eines Zink-Iod-Akkus gezeigt. Das Laden erfolgt durch ein Gebläse, das einen mit einer Zelle verbundenen Generator antreibt. Die Bildung von Iod ist deutlich zu sehen.
Das Entladen erfolgt durch den Antrieb eines Motors durch die Zelle.
'Wasserspaltung - Elektrolyse
Elektrolyse - Hofmann-Apparat
ChemDidaktik-BUW
Wassersynthese
7.4.5 Gesetz von der Erhaltung der Masse
Kohle und Sauerstoff/Erhaltung der Masse
Erhaltung der Masse/Streichhölzer im RG
Zusätzliche Materialien
Chemische Begriffe (einfach)
Young Chemist
Eisbild. sprengt Eisenkugel- Anomalie
zeltersee01 -
Wasser ist zum Waschen da (Lied!)
HotSweetVideos

1. Vom Rohstoff zum Metall – Metalle und Metallgewinnung
8.1.1 Zerlegung von Metalloxiden
8.1.2 Sauerstoffübertragungsreaktionen
8.1.3 Edle und unedle Metalle
8.1.4 Metallrecycling

2. Elemente - Elementfamilien schaffen Ordnung
8.2.1 Physikalische und chemische Eigenschaften Alkalimetalle, Halogene, Edelgase
Katalysator entzündet Wasserstoff
ChemDidaktik-BUW
Lithium
ChemDidaktik-BUW
Natrium
ChemDidaktik-BUW
Alkali- Erdalkalimetalle
Alkalimetalle
Alkalimetalle
Erdalkalimetalle
Erdalkalimetalle
Calcium und Magnesium
ChemDidaktik-BUW
Fällung von Silberhalogeniden

Silberhalogenide
Film vom Experiment
Im Video wird die Fällung verschiedener Silberhalogenide vor einem schwarzen Kontrasthintergrund gegenübergestellt. Hierzu wird zu einer Kaliumfluorid-, Kaliumchlorid-, Kaliumbromid- und einer Kaliumiodid-Lösung sowie zu zwei Blindproben mit Leitungs- und VE (Vollentsalztes)- Wasser Silbernitrat-Lösung getropft.
ChemDidaktik-BUW
Halogene
Chlor und Wasserstoff
Breaking Lab
Iod und Metalle
curiouspeople_B
Halogene-Edelgase
Edelgase
8.2.2 Periodensystem der Elemente
Infos über Elemente
Das Periodensystem - kurz und knapp
Herr Mathe
Das Periodensystem - einfach erklärt
Chemie – simpleclub

Peridodensystem Kennen
App
In zahlreichen Varianten kann man von wenigen wichtigen oder von allen Elementen testen, ob man ihre Stellung im Periodensystem, die Anzahl der Valenzelektronen, oder die Ordnungszahlen selbst herausfindet. Der Umfang beginnt beim Anklicken bis zur Angabe des Ziels eines Rösselsprungs.
Das Periodensystem - 1
musstewissen Chemie
Das Periodensystem - 2
musstewissen Chemie
Umfassendes PSE
N  Roy-Soc.
Roy-Soc.
Nachschlagen - englisch
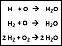
Formeln-Namen
Namen von Verbindungen
Namen von Verb. erweitert
Namen binärer Verbindungen
Namen von Verbindungen
Name /Formel umwandeln

Chemische Gleichungen
App
Hier soll die Ermittlung der Koeffizienten in chemischen Reaktionsgleichungen geübt werden. Dadurch, dass je nach Einstellung leichtere oder schwierigere Gleichungen ohne Koeffizienten vorgegeben werden, kann man sich an die Lösung dieser Problematik herantasten.
!! Hier sind nur ganzzahlige Koeffizienten erlaubt.
!! Hier sind nur ganzzahlige Koeffizienten erlaubt.
Gleichungen

8.4 Differenzierte Atommodelle
8.4.1 Der Atombegriff - Entwicklung
Structure of the Atom 1
stevebd1
Structure of the Atom 2
stevebd1
Auf dem Weg zum Atom
RichardDavidPrecht
8.4.2 Atombau: Elektron, Protonen, Neutronen, Elektronenkonfiguration
Rutherford-Versuch im Trick
owigger
Modell für das Rutherford-Modell
compguy37
Bohr-Modell
Chemie-simpleclub
Kugelwolkenmodell
Chemie-simpleclub
Atommodelle
Atommodelle 2
Atombau
Atombau
Bau ein Atom
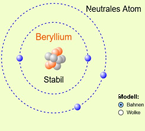
Bau ein Atom
App
Per Simulation kann man Atome bauen. Je nach der eingebauten Protonenzahl erscheint der Name des Elements. Hat man „stabil“ angeklickt, kann man nur eine bestimme Neutronenzahl hinzufügen. Je nachdem, ob man das neutrale Atom oder das entsprechende Ion bauen möchte, fügt man die Elektronen hinzu.

8.5 Stoffmenge (Begriff)
"Mol" - das unbekannte Wesen
musstewissenchemie
Comic zum "Mol"
N  Mol-Uni
Mol-Uni
Molare Masse von Magnesium
E ???
Zusätzliche Materialien
Weitere Hauptgruppen-Elemente
Dritte Hauptgruppe
Vierte Hauptgruppe
Fünfte Hauptgruppe
Chalkogene
Klasse 9 - - Chemistry Learners

9.1 Die Welt der Mineralien - Salze und Ionen
9.1.1 Ionen, Ionenbildung, An- und Kationen, Ionengitter, Ionenbindung (IB)
Verhalten von Ladungen
Reaktion: Natrium mit Chlor
Webcast-legacyD.
Natrium mit Chlor (Microscale)

Reaktion Natrium und Chlor
Film vom Experiment
Im Video wird ein Versuch zur Reaktion von Natrium mit Chlor vorgestellt. Es wird mit einer Injektionsspritze Chlor in die aufgeschmolzene Öffnung eines Reagenzglases zum dort befindlichen geschmolzenen Natrium eingespritzt. In einer stark exothermen Reaktion verbinden sich die Elemente.
Michael Bauer
Entstehung: Ionenbindung
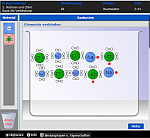
ChemieBaukasten
Die App
Die APP ermöglicht dem Benutzer den modellmäßigen Bau von zahlreichen chemischen Verbindungen. Hier muss der Anwender die Valenzelektronen des Metalls zum Nichtmetall schieben. Wenn die Verbindung gebaut ist, erhält man im 'Baumeistermodus' zahlreiche Informationen zu der gebauten Verbindung. Im 'Chemikermodus' muss man sie selber wissen.
Formeln-Namen-Ionenbindung
9.1.2 Eigenschaften von Ionenverbindungen, elektr. Leitfähigkeit Salzen, Schmelzen und Lösungen
Eigenschaften: Ionenbindung
Ionenbildung / -bindung
Elektr. Leitfähigkeit: Flüssigkeiten
Elektr. Leitfähigkeit: Salze/Schmelzen
9.2 Gehaltsangaben - Verhältnisformel, Gesetz der konst. Massenverhältnisse, Atomanzahlverhältnis, Reaktionsgleichungen
Gleichungen auch in Klasse 8!9.2.1 Gehaltsangaben
Rechnen mit Mol und Konzentration
einfacherklärt
TitrationsTrockenTraining
Titrations Trocken Training
App
Hier kann man ohne Chemikalien und Glasbruch die Durchführung von Titrationen üben. Die Zugabe erfolgt über die Bedienung des Kükens oder über Kippen des Gerätes. Nach dem Zugabeende muss an der Bürette der Verbrauch abgelesen und dann die Konzentration der vorgelegten Lösung berechnet werden.
9.2.2 Reaktionsgleichungen, Stoffmengen
Chemisches Rechnen
Chemie Endlich Verstehen - Flipped Classroom

Gleichungen App
Hier soll die Ermittlung der Koeffizienten in chemischen Reaktionsgleichungen geübt werden. Dadurch, dass je nach Einstellung leichtere oder schwierigere Gleichungen ohne Koeffizienten vorgegeben werden, kann man sich an die Lösung dieser Problematik herantasten.
!! Hier sind nur ganzzahlige Koeffizienten möglich.
!! Hier sind nur ganzzahlige Koeffizienten möglich.
Mol u. Co im Kopf
Rechnen mit Stoffmengen
Gleichungen lösen Schema

9.3 Gase in unserer Atmosphäre – Molekülverbindungen
9.3.1 Unpolare Elektronenpaarbindungen, EPA: Lewis-Schreibweise, räumliche Struktur
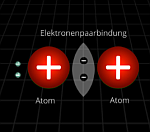
Elektronenpaarbindung (Atombindung)
musstewissen
Entstehung: Elektronen-Paar-Bindung EPB
Eigenschaften: EPB

Chemiebaukasten Die App
Die APP ermöglicht dem Benutzer den modellmäßigen Bau von zahlreichen chemischen Verbindungen. Hier wird ähnlich den Modellkästen für die Organik "gesteckt". Wenn die Verbindung gebaut ist, erhält man im 'Baumeistermodus' zahlreiche Informationen zu der gebauten Verbindung. Im 'Chemikermodus' muss man sie selber wissen.
Chemiebaukasten: EPB: Cl2
Chemiebaukasten: EPB: O2
Chemiebaukasten: EPB: N2
3D Darstell. von Molekülen
9.3.2 Katalysatoren auch: 11.2.7

9.4 Wasser - mehr als ein Lösungsmittel - polare Verbindungen
9.4.1 Polare Elektronenpaarbindungen: Lewis, räuml. Struktur, Dipol
Elektronegativität
Chemie - simpleclub
Elektronegativität
musstewissen
Ablenkung eines Flüssigkeitsstrahls
ChemDidaktik-BUW
Entstehung: EPB mit Ionencharakter
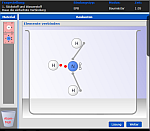
ChemieBaukasten
Die App
Die APP ermöglicht dem Benutzer den modellmäßigen Bau von zahlreichen chemischen Verbindungen. Hier wird ähnlich den Modellkästen für die Organik "gesteckt". Wenn die Verbindung gebaut ist, erhält man im 'Baumeistermodus' zahlreiche Informationen zu der gebauten Verbindung. Im 'Chemikermodus' muss man sie selber wissen.
Eigensch.: EPB mit IC
Elektronenpaarbindung
Dipole und nicht-Dipole
einfach erklärt
Dipol-Dipol-Wechselwirkungen
Chemie - simpleclub
van der Waals-Kraft
Chemie - simpleclub
Formeln-Namen-EPB
9.4.2 Zwischenmolekulare Wechselwirkungen: auch: 10.3.2 auch: 11.1.3 auch: 13.2.4
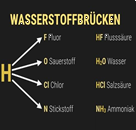
Wasserstoffbrücken
SIMPLECLUB
Wasserstoffbrückenbindung
musstewissen Chemie
Eigensch.: EPB mit IC u. H-Br.
Chemiebaukasten: Wasser: H2O
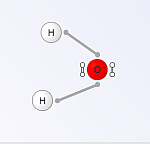
Chemiebaukasten
App
Hier kann man zahlreiche chemische Verbindungen aus den einzelnen Atomen der entsprechenden Elemente simulierend bauen. In diesem Fall ist es das Wassermolekül. Nach dem Bau des Moleküls erhält man einen Überblick über die Eigenschaften dieser Verbindung bzw. man muss die Eigenschaften selbst angeben.
Wasser löst Salz
Animation-CD Wuppertal

9.5 Energie aus chemischen Reaktionen durch Elektronenübertragung
Elektrochemie auch in Jgst. 12!
9.5.1 Reaktionen zwischen Metall-Atomen und -Ionen
Entstehung: Metallbindung
Eigensch.: Metallbindung
Metallische Bindung
Metallbindung
ChemieBaukasten
Die App
Die APP ermöglicht dem Benutzer den modellmäßigen Bau von zahlreichen chemischen Verbindungen. Hier muss der Anwender die Valenzelektronen des Metalls in das Elektronengas schieben. Wenn die Verbindung gebaut ist, erhält man im 'Baumeistermodus' zahlreiche Informationen zu der gebauten Verbindung. Im 'Chemikermodus' muss man sie selber eingeben.
Reaktionen von Metallen mit Metallsalzlösungen
ChemDidaktik-BUW
9.5.2 Oxidation, Reduktion
9.5.3 Energiequellen: Galvanische Elemente, Akkumulator, Batterie, Brennstoffzelle
Büroklammerbatterie-Cu/Zn

Büroklammer Batterie
Video vom Experiment
Das Video zeigt ein Beispiel für eine galvanische Stromquelle. Ein mit Filterpapier umwickeltes Zinkblech wird an eine verkupferte Büroklammer geklemmt. Als Elektrolyt wird verdünnte Salzsäure eingesetzt. Am Messgerät und am sich drehenden Motor sieht man, dass das galvanische Element funktioniert.
Cu/Zn-Zitronenbatterie

Zitronen- Batterie
Video vom Experiment
Das Video zeigt ein Beispiel für eine galvanische Stromquelle. In eine Zitrone werden parallel zueinander ein Zink- und ein Kupferblech eingesteckt. Der Zitronensaft dient als Elektrolyt. Am Messgerät und am sich drehenden Motor sieht man, dass das galvanische Element funktioniert.
Apfel/Kartoffelbatt Cu/Zn

Apfel-/Kartoffel- Batterie
Video vom Experiment
Das Video zeigt ein Beispiel für eine galvanische Stromquelle. In einen Apfel (Kartoffel, Birne) werden parallel zueinander ein Zink- und ein Kupferblech eingesteckt. Der Saft in den Früchten dient als Elektrolyt. Am Messgerät und am sich drehenden Motor sieht man, dass das galvanische Element funktioniert.
Cu/Zn Leitungswasser- Batterie

Leitungswasser Batterie
Video vom Experiment
Hier wird ein erstaunliches galvanisches Element mit Kupfer- und Zink-Elektroden gezeigt. Der Elektrolyt ist hier reines Leitungswasser. Man muss allerdings schon zwei „Tricks“ anwenden. 1. Die Plattenoberfläche muss recht groß sein. 2. Die Platten müssen sehr dicht aneinander (ohne Kurzschluss!) angeordnet sein. Hier stehen sie in einem Becherglas 600 mL.
Mg/I2- Batterie

Magnesium-Iod Batterie
Video vom Experiment
Eine interessante Magnesium-Iod-Batterie kann folgendermaßen hergestellt werden: Auf einen Anspitzer aus Magnesium legt man ein mit Kaliumnitrat getränktes Filtrierpaper. Auf das Papier gibt man ein kleines Körnchen Iod. Verbindet man das Magnesium und das Iod mit einem Spannungsmesser, so sieht man eine leistungsfähige galvanische Zelle.
Salzwasser-Batterie Mg/O2
Mg/O2- Salzwasser- Auto
'RedBull'- Batterie Al/O2
LowCost-Brennstoffzelle

LowCost Brennstoffzelle
Video vom Experiment
Hier wir eine LowCost-Brennstoffzelle gezeigt, deren wichtigste Merkmale alte Scherblätter vom Elektrorasierer sind. (Der Hauptbestandteil sind Nickel oder -legierungen, die an der Oberfläche dünn mit Platin belegt sind). Elektrolysiert man Kalilauge, bleiben genügend Gase an den Oberflächen haften, um ein galvanisches Element zu bilden: Der Motor dreht sich.
ChemDidaktik-BUW
Wie funktioniert die Brennstoffzelle
Chemie-simpleclub
9.5.4 Elektrolyse auch: 12.2.5
Elektrolysen
Elektrolyse Salatbecher
Elektrolyse
Chemie – simpleclub
Zusätzliche Materialien
Begriffe - Klasse 9
Elemente
Bindungen gemischt
Bindungen
Namen komplizierter Verbindungen

10.1 Saure und alkalische Lösungen in unserer Umwelt
10.1.1 Eigenschaften saurer/alkalischer Lösungen
Säure / Base SI
Chlorwasserstoff-Springbrunnen

HCl- Springbrunnen
Video vom Experiment
In einem einfachen, aber eindeutigen Experiment wird Chlorwasserstoff durch Erhitzen von Salzsäure in einen Kolben ausgetrieben. Mit einer Düse versehen wird der Kolben in ein größeres Becherglas mit Bromthymolblau angefärbtem Wasser gestülpt. Nach einiger Anlaufzeit sieht man das Wasser in den Kolben spritzen.
Ammoniak-Springbrunnen
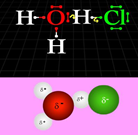
Reaktion st. Säure mit Wasser
Animation
In dieser App wird die Reaktion einer starken Säure (hier: HCl; Chlorwasserstoff)) mit Wasser simuliert. Bei dieser Protolyse gibt das Chlorwasserstoffmolekül ein Proton vollständig an ein Wassermolekül ab. Es bilden sich Oxoniumionen und Chloridionen. Die Lösung wird als Salzsäure bezeichnet.
10.1.2 Ionen in sauren/alkalischen Lösungen

Ionenwanderung
Video vom Experiment
Salzsäure bzw. Natronlauge werden auf Indikatorpapier getüpfelt. Das Indikatorpapier wird angefeuchtet und an eine Gleichspannungsquelle angeschlossen. Die Wanderung der Oxoniumionen (Rotfärbung) in Richtung der Kathode kann man genauso verfolgen wie die langsamere Wanderung der Hydroxidionen (Blaufärbung) in Richtung Anode.

Leitfähigkeits-Labor
Animation Experiment
Es wird ein Messplatz zur Untersuchung der Zusammenhänge bei der elektrischen Leitfähigkeit von Salzlösungen simuliert. Man legt eine konstante Gleichspannung an, polt um oder stellt auf Wechselspannung. Dabei wird jeweils das Strommessgerät beobachtet. Auch die Konzentration und die Art der Ionen können variiert werden.
10.2 Reaktionen von sauren mit alkalischen Lösungen
10.2.1 Neutralisation und Salzbildung
10.2.2 Stöchiometrie: Stoffmenge, Stoffmengenkonzentration
Einfach erklärt: Quantitative Chemie
chemistry@home
Titrationen Durchführen/Auswerten
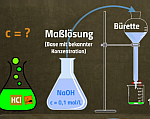
Titrationen Durchführen Auswerten
Lehrvideo
Schöne Einführung in die Durchführung und Auswertung von Titrationen. Es wird erklärt, warum man eine Titration durchführt. Dann werden die Geräte für eine Titration vorgestellt.
Den Ablauf des Experiments kann man verfolgen.
Auch die Auswertung (Berechnungen) lässt sich gut nachvollziehen.
Den Ablauf des Experiments kann man verfolgen.
Auch die Auswertung (Berechnungen) lässt sich gut nachvollziehen.
Stöchiometrie automatisch lösen
10.2.3 Protonenabgabe und -aufnahme an einfachen Beispielen
SIMPLECLUB
Protolye
pH-Werte versch. Salzlösungen
ChemDidaktik-BUW
Reaktion: schwache Säure mit Wasser
Reaktion von Wasser mit Wasser
TitrationsTrockenTraining
Titrations Trocken Training
App
Hier kann man ohne Chemikalien und Glasbruch die Durchführung von Titrationen üben. Die Zugabe erfolgt über die Bedienung des Kükens oder über Kippen des Gerätes. Nach dem Zugabeende muss an der Bürette der Verbrauch abgelesen und dann die Konzentration der vorgelegten Lösung berechnet werden.

pH-Titration
Video vom Experiment
Salzsäure unbekannter Konzentration wird mit Natronlauge, c = 0,1 mol/L titriert. Die Salzsäure-Lösung wurde mit etwas Bromthymolblau versetzt. Während der Titration wird der pH-Wert mithilfe eines pH-Meters bestimmt. Die ermittelten pH-Werte, die Indikatorfarbe und die zugegebene Menge an Natronlauge werden in einer Tabelle festgehalten.
ChemDidaktik-BUW
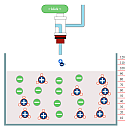
Titrationskurven
Quantitatives Üben
In dieser App kann man das Entstehen verschiedener Titrationskurven entweder automatisch oder durch selbstständiges Rechnen verfolgen. Man sieht, welche Konzentrationen welcher Ionensorten die einzelnen "Kurventeile" beeinflussen. Beeindruckend: Durch Logarithmieren der H3O+ bzw. OH-- Konzentrationen erhält man aus der Leitwertkurve eine pH-Kurve.
Säuren-Basen-light
Säuren-Basen-pH

10.3 Alkane und Alkohole in Natur und Technik – Organische Chemie
Kohlenstoffverbindungen auch in Jgst. 11!
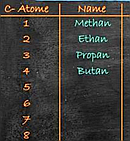
10.3.1 Alkane und Alkanole als Stoffklassen
Methan - Eigenschaften
JGS Feuchtwangen
Alkane - Eigenschaften
JGS Feuchtwangen
Nomenklatur Einführung
- SimpleClub
Nomenklatur Alkane
Nomenklatur Alkane Plus
Alkane
Alkanole
10.3.2 Zwischenmolekulare Wechselwirkungen: auch: 9.4.2 auch: 11.1.3 auch: 13.2.4
10.3.3 Treibhauseffekt

10.4 Vielseitige Kunststoffe – Organische Chemie
10.4.1 Makromoleküle: ausgewählte Kunststoffe
Kunststoffe / Vernetzungsgrad
HTW BERLIN
Kunststoffe - Anwendung
HTW BERLIN
Kunststoffe
Kunststoffe
Zusätzliche Materialien
Chemische Begriffe
Definitionen
Begriffe - Klasse 10
Weitere Begriffe
Abkürzungen
vor der Organik
Organische Reaktionen
Erdöl-Kraftstoffe
OC1 - Alkane - Erdöl

11.1 Kohlenstoffverbindungen
Alkane /Alkanole auch in Klasse 10!
11.1.1 Struktur- Eigenschaftsbeziehungen: Stoffklassen und funktionelle Gruppen:
Alkane, Alkene, Alkohole, Aldehyde, Ketone, Carbonsäuren, Ester
Einf. org. Elementaranalyse
Kohlenwasserstoffe
Funktionelle Gruppen
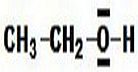
Funktionelle Gruppen
AK Riddle
App
Ein spannendes Rate-Lern-Quiz ähnlich Kahoot.
Es erzeugt eine knisternde Spannung, weil die Schüler gegeneinander um Punkte kämpfen.
Sie lernen dabei, ohne es zu merken.
Hier soll erraten werden wie die funk-tionelle Gruppe einer organischen Verbindung bzw. wie die Verbindung heißt.
Es erzeugt eine knisternde Spannung, weil die Schüler gegeneinander um Punkte kämpfen.
Sie lernen dabei, ohne es zu merken.
Hier soll erraten werden wie die funk-tionelle Gruppe einer organischen Verbindung bzw. wie die Verbindung heißt.
Funktionelle Gruppen
Mesomerie
Chemie-simpleclub
Mesomere Grenzformeln
Chemistryathome
Atomorbitale
Chemie-simpleclub
Molekülorbitale
Chemie-simpleclub
OC2-Alkohole
OC3-Stoffklassen
Alkanole
ungesättigte KW
Viskosität verschiedener Alkohole
ChemDidaktik-BUW
Vom Alkohol zum Aldehyd oder Keton
ChemDidaktik-BUW
Alkanale - Alkanone
Alkansäuren
Alkanale-one
Alkansäuren
Aminosäuren
11.1.2 Homologe Reihen und Isomerie
11.1.3 Zwischenmolekulare Wechselwirkungen: auch: 9.4.2 auch: 10.3.2 auch: 13.2.4
11.1.4 Kohlenstoffmodifikationen
Modifikationen des Kohlenstoffs
GIDA - Filme (Trailer)
Diamant und Graphit
Duden Learnattack
11.1.5 Kohlenstoffkreislauf

11.2 Gleichgewichte
11.2.1 Chemisches Gleichgewicht
Der Stechheber-Versuch
ChemDidaktik-BUW
NO2 - N2O4 - Gleichgewicht (Temp)

NO2 - N2O4 - Gleichgewicht (Temp)
Video vom Experiment
Die Lage eines Gleichgewichts kann durch die Temperatur beeinflusst werden.
In Video wird eine Temperaturbeeinflussung eingesetzt. Die verschiedenen Farben bei verschiedenen Temperaturen zeigt das Vorhandensein von mehr oder weniger des braun gefärbten NO2.
ChemDidaktik-BUW
NO2 - N2O4 - Gleichgewicht (Druck)

NO2 - N2O4 - Gleichgewicht (Druck)
Video vom Experiment
Spielen bei einer Reaktion Gase eine Rolle, so kann die Lage eines Gleichgewichts verändert werden, wenn das Eduktvolumen ≠ Produktvolumen. Im Video wird eine Druckbeeinflussung eingesetzt. Die verschiedenen Farben bei verschiedenen Drucken zeigen das Vorhandensein von mehr oder weniger des braun gefärbten NO2.
Didaktische Medien
Lösegleichgewicht
11.2.2 Reaktionsgeschwindigkeit
Ameisensäure-Magnesium-Kinetik

Ameisensäure Magnesium Kinetik
Video vom Experiment
Im Video wird gezeigt, wie mit einer einfachen Versuchsapparatur die Reaktionsgeschwindigkeit der Reaktion zwischen Ameisensäure und Magnesium ermittelt werden kann. Hierzu wird in 10-Sekunden-Abständen das Volumen des entstandenen Gases ermittelt und in eine Tabelle eingetragen.
ChemDidaktik-BUW
Marmor und Salzsäure
E ????
Kinetik
11.2.3 Donator-Akzeptor-Konzept
11.2.4 Oxidationszahlen und -reihen
11.2.5 Energie bei chemischen Reaktionen auch: 7.2.2
11.2.6 Aktivierungsenergie und Reaktionsdiagramm
11.2.7 Katalyse auch: 9.3.2
11.2.8 Massenwirkungsgesetz auch: 12.1.7
Veresterung / Verseifung
D ????
Massenwirkungsgesetz
MWG
Zusätzliche Materialien
Trivialnamen
Fette-Öle
Tenside
Waschmittel
D  Hangman
Hangman
Kohlenhydrate
Zucker
D  Hangman
Hangman
optische Aktivität
Eiweiße
Proteine
D  Hangman
Hangman

12.1 Vom Rohstoff zum Werkstoff - Organische Chemie
12.1.1 Stoffklassen und Reaktionstypen
Funktionelle Gruppen und Benennung
Wolfgang Dukorn
Stoffklassen und funktionelle Gruppen
S.Kutz
Funktionelle Gruppen, Tabelle und Erklärung
Studyflix
12.1.2 Radikalische Substitution (inkl. Reaktionssteuerung durch Licht) !nicht im KLP!
12.1.3 Elektrophile Addition
12.1.4 LK: Nucleophile Substitution
12.1.4 LK: Reaktionsschritte
Reaktion ohne KLP: Eliminierung
12.1.5 Eigenschaften makromolekularer Verbindungen
12.1.6 Polykondensation und radikalische Polymerisation
Kunststoffe nach Entstehungsreaktion
Leh/Ler-HTW BERLIN
Nylon - Polykondensation
ChemDidaktik-BUW
Polykondensation-Kunststoffherstellung
Chemie simpleclub
Polykondensation
SchulLV
Polyadditon
Chemie-simpleclub
Polyadditon
SchulLV
Radikalische Polymerisation
SchulLV
PMMA - radikalisch polymerisiert
ChemDidaktik-BUW
Kunststoffe
12.1.7 Massenwirkungsgesetz / Chemisches Gleichgewicht auch: 11.2.8
Prinzip von Le Chatelier
SchulLV
Massenwirkungsgesetz
SchulLV
Massenwirkungsgesetz
alteso.de
Massenwirkungsgesetz
Duden Learnattack
Gleichgewichtskonstante
Duden Learnattack
12.1.8 Reaktionssteuerung
und LK: Produktausbeute

12.2 Elektrochemie
Energie durch Elektronenübertragung auch in Klasse 9!
12.2.1 Umkehrbarkeit von Redoxreaktion – chem. Gleichgewicht
LowCost-Brennstoffzelle
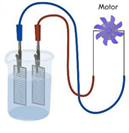
LowCost-Brennstoffzelle
Video vom Experiment
In einem Low-Cost-Aufbau, bestehend aus zwei Metallelektroden und einer Kaliumhydroxid-Lösung werden zuerst durch Elektrolyse Wasserstoff und Sauerstoff hergestellt. Die Bildung von Gasblasen an beiden Elektroden wird gezeigt. Anschließend wird mit dieser Zelle ein Motor betrieben.
ChemDidaktik-BUW
12.2.2 Donator-Akzeptor-Prinzip
12.2.3 Spannungsreihe der Metalle und Nichtmetalle
12.2.4 Galvanische Zellen
12.2.5 Elektrolyse auch: 9.5.4
12.2.6 Elektrochemische Korrosion - LK: Korrosionsschutz
12.2.7 Energieumsatz
12.2.8 Faraday-Gesetze
12.2.9 Elektrochemische Energieumwandlung
Zink-Iod-Akku

Zink-Iod-Akku
Film vom Experiment
Im Video wird das Laden und Entladen eines Zink-Iod-Akkus gezeigt. Das Laden erfolgt durch ein Gebläse, das einen mit einer Zelle verbundenen Motor antreibt. Die Bildung von Iod ist deutlich zu sehen. Das Entladen erfolgt durch den Antrieb eines Motors durch die Zelle.
12.2.10 Standardelektronenpotential
LK: Nernst-Gleichung

Red & Ox
App
Die App Red & Ox ist dazu gedacht, dass man seine Kenntnisse zu den Begriffen Oxidation und Reduktion, sowie zum Aufstellen von Redox-gleichungen erweitern kann. Man kann verschiedene Schwierigkeitsgrade zu den Themen Oxidationszahlen (auch aus der OC), Redoxgleichungen, Zementierungsreaktionen und Potenzialberechnungen wählen.
Redoxreaktionen

Redoxreaktionen
Lehrvideo
Hier wird die elektrochemische Span-nungsreihe der Metalle beschrieben. Die Begriffspaare Oxidation und Reduktion sowie Oxidationsmittel und Reduktionsmittel werden erklärt. Es wird erklärt, warum ein Eisennagel beim Eintauchen in eine Kupfersulfatlösung verkupfert, aber ein Kupferstab beim Eintauchen in eine Eisensalzlösung nicht mit Eisen überzogen wird.
musstewissenchemie
Nernst-Gleichung
SIMPLECLUB
Nernst-Gleichung
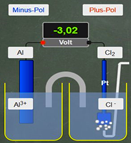
Potential-Rechner
App
Gezeigt wird eine galvanische Zelle, bei der in beiden Halbzellen (mit AK Rollen) die vorgegebenen Redoxpaare geändert werden können. Auch die Konzentrationen der Ionen in Lösungen lassen sich per Tastatur eingeben. Die Einzelpotenziale werden berechnet und die daraus resultierende Potenzialdifferenz auf dem Messgerät angegeben.
Elektrochemie
Elektrochemie
Elektrochemie
12.2.12 LK: Kenndaten von Batterien und Akkumulatoren

12.3 Säuren, Basen und analytische Verfahren
Saure und alkalische Lösungen auch in Klasse 10!
12.3.1 Struktur-Eigenschaftsbeziehungen
12.3.2 Merkmale von Säuren und Basen
Ammoniak-Springbrunnen
Chlorwasserstoff-Springbrunnen

HCl- Springbrunnen
Video vom Experiment
In einem einfachen, aber eindeutigen Experiment wird Chlorwasserstoff durch Erhitzen von Salzsäure in einen Kolben ausgetrieben. Mit einer Düse versehen wird der Kolben in ein größeres Becherglas mit Bromthymolblau angefärbtem Wasser gestülpt. Nach einiger Anlaufzeit sieht man das Wasser in den Kolben spritzen.
12.3.4 Säuren und Basen - Elektrische Leitfähigkeit

Leitfähigkeits-Labor
Animation Experiment
Es wird ein Messplatz zur Untersuchung der Zusammenhänge bei der elektrischen Leitfähigkeit von Salzlösungen simuliert. Man legt eine konstante Gleichspannung an, polt um oder stellt auf Wechselspannung. Dabei wird jeweils das Strommessgerät beobachtet. Auch die Konzentration und die Art der Ionen können variiert werden.
In TH PC iO A
Konduktometrische Titration
????
Berechn. Titr-kurven
Simulation
12.3.5 Chemisches Gleichgewicht
12.3.6 Autoprotolyse von Wasser
Reaktion von Wasser mit Wasser
Autoprotolyse von Wasser
Chemie – simpleclub
12.3.7 pH-Wert
Größenvorstellung: 10-7
pH-Beispiele (vorläufig)

pH- Rechner
App
Es können die in der Schule üblichen Säuren und Basen, sowie Gemische (=Pufferlösungen) aus diesen ausgewählt werden. Nach Angabe der Konzentration(en) wird der zugehörige pH-Wert berechnet und die Farbe des Universalindikators angezeigt. Soll nur der pH-Wert einer reinen Lösung berechnet werden, stellt man die zweite Rolle auf "Keine".
12.3.8 Stärke von Säuren
Reaktion einer starken Säure
Reaktion einer schwachen Säure
Schwache Säuren und Basen
12.3.9 Donator-Akzeptor-Prinzip - Brönstedt-Theorie - Protonenübergänge
12.3.10 LK: pH-metrische Titration
Titration mit Teilchen
Simulation
Berechn. Titr-kurven
Simulation
TitrationsTrockenTraining

Titrations Trocken Training
App
Hier kann man ohne Chemikalien und Glasbruch die Durchführung von Titrationen üben. Die Zugabe erfolgt über die Bedienung desKükens oder über Kippen des Gerätes. Nach dem Zugabeende muss an der Bürette der Verbrauch abgelesen und dann die Konzentration der vorgelegten Lösung berechnet werden.

pH-Titration
Video vom Experiment
Salzsäure unbekannter Konzentration wird mit Natronlauge, c = 0,1 mol/L titriert. Die Salzsäure-Lösung wurde mit etwas Bromthymolblau versetzt. Während der Titration wird der pH-Wert mithilfe eines pH-Meters bestimmt und dieser mit dem Teacher's Helper an alle Schüler übertragen. Die Auswertung muss jeder machen.
Essigsäure und Natronlauge
E ????
Phosphorsäure und Natronlauge
E ????
12.3.11 LK: Neutralisationswärme
Zusätzliche Materialien
Jahrgangsstufe 13 - - Profi Chemists
13.1 Organische Chemie – Aromatische Verbindungen und Farbstoffe
13.1 Aromatische Verbindungen
13.1.1 Benzol als aromatisches System
und LK: Phenol
13.1.2 Elektrophile Erstsubstitution
und LK: Zweitsubstitution
13.1.3 LK: Vergleich Ae und Se - Reaktion
Elektrophile Addition Brom an Ethen
Chemie – simpleclub
Elektrophile aromatische Substitution
Chemie – simpleclub

13.2 Farbstoffe
13.2.1 Spektrum und Lichtabsorption
13.2.2 Energiestufenmodell zur Lichtabsorption
Wie funktioniert das mit der Farbigkeit
Chemie – simpleclub
Emission und Absorption von Licht
Lehrer Schwarze
13.2.3 Molekülstruktur und Farbigkeit
Farbigkeit
Farben
Farbstoffe
Farbstoffe
Farbigkeit
SIMPLECLUB
Azofarbstoffe
Triphenylfarbstoffe
weitere Farbstoffe
13.2.4 Zwischenmolekulare Wechselwirkungen: auch: 9.4.2 auch: 10.3.2 auch: 11.1.3
13.2.5 LK: Lambert-Beer-Gesetz
Fotometrie Messgrößen
Fotometrie
Kristallviolett-Verdünnungsreihe
E ????
Das Lambert-Beersche Gesetz
Chemie – simpleclub
Gesetz von Lambert-Beer